強酸性陽イオン交換樹脂
強酸性陽イオン交換樹脂の概要
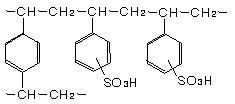
強酸性陽イオン交換樹脂の化学構造
※商品にはNaおよびHイオン形があります。
強酸性陽イオン交換樹脂は、下記の化学構造のようにスルホン酸基(-SO3H)を交換基として持つ樹脂では塩酸、硫酸などの鉱酸と同様に解離して強酸性を示し、Na+イオンやCa2+イオンのような陽イオンを交換することができます。
全てのpH領域(0~14)で使用でき、温度にも比較的安定で100~120℃の高温にも耐えることから、純水・軟水製造の水処理を始め、医薬品・食品の精製、触媒等広い分野で使用されています。
交換基であるスルホン酸基(-SO3H)は強酸性であり、アルカリ側は勿論のこと、酸性の溶液中でも-SO3- H+の形に解離します。-SO3-を固定イオン、H+を対イオンと呼びます。
イオン交換は対イオンの交換反応ですが、強酸性陽イオン交換樹脂は以下に示す式のように、塩基(NaOH)は言うまでもなくNaClやCaCl2のような中性塩も分解交換することが出来ます。
R-SO3H + NaCl → R-SO3Na + HCl
2R-SO3H + CaCl2 → (R-SO3)2Ca + 2HCl
R-SO3H + NaOH → R-SO3Na + H2O
(Rはイオン交換樹脂の母体を示します。)
Hイオンが他の陽イオンで交換されてしまうと、もうイオン交換が出来ません。このため、薬剤を使用してR-SO3Hの形に戻して、繰り返し使用します。この操作を再生と言い、薬剤は一般的に塩酸または硫酸水溶液を使用します。
例えば、Na形の再生は以下に示す式のように行われます。
R-SO3Na + HCl → R-SO3H + NaCl
2R-SO3Na + H2SO4 → 2R-SO3H + Na2SO4
強酸性陽イオン交換樹脂は強酸性のため再生しにくく、高い再生率を得るためには理論化学当量より多量の再生剤が必要となります。
強酸性陽イオン交換樹脂のイオン選択性
強酸性陽イオン交換樹脂はあらゆる陽イオンを吸着しますが、イオンの種類によって吸着する強さが異なります。この吸着する強さの指標を選択性と言います。一般的なイオンの選択性は、価数が高いイオン程、選択性が大きくなります。(例えばNa+ < Ca++ < Al+++ < Th++++ ) イオンの価数が同じ場合には原子番号が大きいものほど選択性が大きくなります。(Li+ < Na+ < K+ <Rb+ < Cs+、Mg++ <Ca++ < Sr++ <Ba++ )
強酸性陽イオン交換樹脂一覧
※ 最低販売数量に制限有。お問い合わせください
